10. 11. 2017 | Mladina 45 | Družba
Zdravila za raka so vse dražja, njihov učinek pa je pogosto dvomljiv
Drago upanje
Bolniki z rakom pogosto nimajo časa čakati še nekaj mesecev na zaključek še ene raziskave, ki bi dokončno potrdila učinkovitost novega zdravila.
© Borut Krajnc
Pri zdravljenju raka smo v razburljivem obdobju. Na trg prihajajo nova in nova napredna biološka zdravila, namenjena za točno določene vrste rakavih obolenj. Številna pomenijo upanje za bolnike, ki še do nedavnega niso imeli možnosti.
Zakup člankov
Celoten članek je na voljo le naročnikom. Če želite zakupiti članek, je cena 4,5 EUR. S tem nakupom si zagotovite tudi enotedenski dostop do vseh ostalih zaklenjenih vsebin. Kako do tedenskega zakupa?
10. 11. 2017 | Mladina 45 | Družba

Bolniki z rakom pogosto nimajo časa čakati še nekaj mesecev na zaključek še ene raziskave, ki bi dokončno potrdila učinkovitost novega zdravila.
© Borut Krajnc
Pri zdravljenju raka smo v razburljivem obdobju. Na trg prihajajo nova in nova napredna biološka zdravila, namenjena za točno določene vrste rakavih obolenj. Številna pomenijo upanje za bolnike, ki še do nedavnega niso imeli možnosti.
Vsa po vrsti so izjemno draga. Štiri ali pet tisoč evrov za enomesečno zdravljenje je že povsem vsakdanja cena. Izdatki slovenske zdravstvene blagajne za onkološka zdravila so se v zadnjih 15 letih podeseterili. Zanje se na leto porabi že približno 80 milijonov evrov, kar je že skoraj petina izdatkov, ki jih ima Zavod za zdravstveno zavarovanje z zdravili.
Da farmacevtske družbe draga zdravila, ki jim prinesejo tudi po nekaj milijard evrov na leto, sploh lahko ponudijo na trgu, morajo najprej dokazati, da so ta zdravila učinkovita, in dobiti dovoljenje za promet z njimi. V Evropski uniji je za presojo učinkovitosti in izdajo dovoljenj pristojna Evropska agencija za zdravila (EMA). Z njeno odobritvijo so zdravilu odprte vse države EU.
Skupina britanskih strokovnjakov se je odločila preveriti, kako dobro EMA opravlja vlogo filtra za nova zdravila. Prišla je do skrb zbujajočih ugotovitev.
Slabi dokazi
Za najbolj prepričljivo merilo učinkovitosti zdravila v onkologiji velja z dvojno slepo randomizirano klinično raziskavo pridobljen dokaz, da neko zdravilo v primerjavi z drugimi zdravljenji, ki so na voljo, bodisi podaljša preživetje bolnika bodisi izboljša kakovost njegovega življenja. Strokovnjaki, ki so svoje ugotovitve prejšnji mesec objavili v medicinski reviji British Medical Journal (BMJ), so se zato odločili pregledati, kako so nova zdravila ustrezala tema meriloma učinkovitosti v trenutku, ko jim je EMA izdala dovoljenje za promet. Izbrali so si obdobje med letoma 2009 in 2013. V tem obdobju je agencija odobrila 48 onkoloških zdravil za zdravljenje 68 indikacij. Ugotovili so, da v več kot polovici primerov raziskave, s katerimi so proizvajalci zdravil dokazovali učinkovitost svojih izdelkov, niso dokazale ne podaljšanja preživetja ne izboljšanja kakovosti življenja bolnikov.
Ali torej EMA pri zdravilih za zdravljenje raka preveč na lahko podeljuje dovoljenja za promet? Ali zdravstvene blagajne namenjajo milijonske zneske za zdravila, katerih učinkovitost ni dokazana?
»Povečuje se skrb, da so koristi številnih novih zdravil za zdravljenje raka, ki jih pogosto predstavljajo kot ’prebojna’, neredko zelo majhne in v praksi nepomembne za bolnika,« opozarja študija. Ko za taka draga zdravila plačuje javni zdravstveni sistem, pa to lahko pomeni »škodovanje bolnikom, zapravljanje dragocenih sredstev in spodkopavanje zagotavljanja učinkovite in pravične zdravstvene nege za vse«.
Večina v študiji omenjenih zdravil je dostopna tudi slovenskim bolnikom.
Odrekanje upanja
Rak je kralj bolezni. Je bolezen, ki zbuja največ strahu, ki človeka prisili, da se zelo jasno zave svoje minljivosti in da išče vse mogoče načine za ozdravitev. Vsako novo potencialno zdravilo daje bolnikom novo upanje. To upanje jim je težko odreči. »Nihče ne želi biti tisti, ki bo rekel NE zdravilu za raka,« pravi eden od sogovornikov, ki so ga pri BMJ prosili za komentar.
Ustvarja se velik pritisk na regulatorje, da obetavna zdravila čim prej spustijo do bolnikov, da na smrt bolnim ne odrekajo morebitne rešilne bilke. Glavna urednica BMJ Fiona Godlee ugotavlja, da se je proti takim pritiskom težko boriti. »Raziskovalci bodo vedno želeli hvaliti svoje delo, proizvajalci svoje izdelke, mediji hlepijo po čustvenih zgodbah, obupani bolniki pa so pripravljeni poskusiti tudi z zdravili, katerih učinkovitost ni dokazana.«
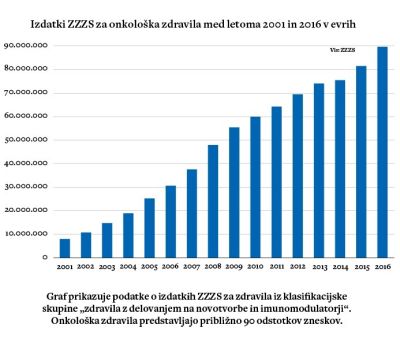
Graf prikazuje podatke o izdatkih ZZZS za zdravila iz klasifi kacijske skupine „zdravila z delovanjem na novotvorbe in imunomodulatorji“. Onkološka zdravila predstavljajo približno 90 odstotkov zneskov.
Bolniki z rakom pogosto nimajo časa čakati še nekaj mesecev, da se konča še ena raziskava, ki bi dokončno potrdila učinkovitost zdravila. Od oddaje vloge proizvajalca zdravila regulatorni agenciji do odobritve onkološkega zdravila v Evropi že tako v povprečju preteče skoraj leto. Zadevo dodatno zaplete dejstvo, da je za številne redke oblike raka sploh težko zbrati dovolj bolnikov za zanesljivo klinično raziskavo. Ker so nova zdravila večinoma usmerjena v točno določene podvrste sicer pogostih rakov, se tudi v teh primerih redno pojavlja težava z zagotavljanjem dovolj sodelujočih v raziskavi.
Evropska agencija za zdravila pogosto odobri nova zdravila za zdravljenje raka brez dokazov, da ta podaljšajo preživetje bolnikov ali izboljšajo kakovost njihovega življenja.
Ko je potreba po učinkovitem zdravilu zelo velika, lahko regulatorne agencije postopek odobritve tudi pospešijo in novo zdravilo odobrijo še pred koncem vseh potrebnih raziskav. Veliko takih zdravil se spremeni v zgodbe o uspehu. Tak primer je bilo zdravilo imanitib, ki je kronično mieloično levkemijo iz pogosto usodne bolezni spremenilo v obvladljivo.
Hkrati pa, kot ugotavlja študija, objavljena v BMJ, taka zdravila lahko vztrajajo na trgu tudi po več let, ne da bi bila njihova učinkovitost ustrezno dokazana. Od desetih zdravil, ki jih je EMA med letoma 2009 in 2013 odobrila po hitrem postopku, štiri leta kasneje niti za eno od njih ni bilo dokazov o podaljšanju življenjske dobe ali izboljšanju kakovosti življenja bolnikov.
Previsoki standardi
EMA se s kritiko, češ da je pri onkoloških zdravilih preveč zrahljala merila za odobritev, ne strinja. »Omejitev odobritev novih onkoloških zdravil na primere, pri katerih obstajajo neizpodbitni dokazi za podaljšanje preživetja in izboljšanje kakovosti življenja, ne bi koristila bolnikom. Nasprotno, tak način obravnave bi jih lahko prikrajšal za hiter dostop do učinkovitih zdravil, ki jih nujno potrebujejo.« Kot poudarjajo v agenciji, mora včasih za odobritev zadostovati tudi dokazan odziv bolnikov na zdravljenje ali podaljšan čas brez napredovanja bolezni. Pri odločanju o odobritvi zdravila pa upoštevajo vse relevantne podatke, »tudi potrebo po učinkovitih zdravilih v primerih, pri katerih ni na voljo nobeno uveljavljeno zdravljenje«.

Jutranja gneča pred zadnjim vhodom v Onkološki inštitut.
© Borut Krajnc
Zelo kritična do članka v BMJ je tudi slovenska onkologinja dr. Tanja Čufer s Klinike Golnik. Učinkovitosti novih onkoloških zdravil po njenih besedah preprosto ne bi smeli presojati zgolj na podlagi dokazanega podaljšanja preživetja ali izboljšanja kakovosti življenja. »Kakovost življenja je zelo težko izmeriti. Vprašalniki so zamudni, nepregledni in za številne bolnike preobsežni. Le redke raziskave sploh poročajo o kakovosti življenja.« Kar se tiče podaljšanega preživetja, pa ga je po njenem mnenju težko dokazati zaradi specifičnih zakonitosti preizkušanja novih zdravil za raka.
Bolniki so v kliničnih raziskavah navadno razdeljeni v dve skupini – tisto, ki prejema novo zdravilo, in tisto, deležno standardnega zdravljenja, ki je že na voljo. A če oziroma ko se stanje bolnikov, ki prejemajo standardno terapijo, poslabša, so tudi oni upravičeni do novega zdravila. Tako imenovano ’cross-over’ zdravljenje je etična obveza kliničnih preizkušanj v onkologiji.
Kot opozarja Tanja Čufer, je zaradi tega težko dokazati boljše preživetje z novim zdravilom. »Kajti večina bolnikov na koncu le dobi tudi novo zdravilo, ki podaljša življenje. Etično je tako edino prav, ni pa mogoče nato dokazati boljšega preživetja.«
Zato je po njenem mnenju prav, da EMA nova protirakava zdravila registrira tudi na podlagi drugih ciljev, kot so na primer zadovoljiv delež bolnikov, ki se odzovejo na zdravljenje, čas do napredovanja bolezni, manjša toksičnost ... »Navsezadnje so to za registracijo številnih zdravil zunaj onkologije povsem normalni in legitimni cilji.« Mogoče, pravi, so si v onkologiji postavili previsoke standarde. »Za boljše obvladovanje raka nujno potrebujemo nova zdravila in rakavi bolniki preprosto nimajo časa mesece in leta čakati na potrditvene raziskave.«
Pri slovenskem regulatorju, Javni agenciji za zdravila in medicinske pripomočke, članku v BMJ očitajo tendencioznost. »Beremo ga, kot da bi po mnenju avtorjev večino odobrenih onkoloških zdravil EMA morala zavrniti kot neučinkovita. Avtorji to sporočajo, ne da bi analizirali morebitne parcialne prednosti za posamezne bolnike v tako zelo heterogeni in pogosto življenjsko ogroženi populaciji, kot so onkološki bolniki. Za primerjavo, kaj bi taka regulatorna praksa pomenila, si lahko zamislimo, da bi pristojni državni organ zavrnil homologacijo avtomobilov z osmimi air-bagi, ker bi iz trenutno zbranih podatkov statistično ugotovil, da povečajo varnost pri premajhnem številu nesreč v primerjavi s tistimi, ki jih imajo šest.«
Dodatna varovalka
Ko EMA odobri novo zdravilo, to dobi zeleno luč za trženje v EU. To pa še ne pomeni, da bo dejansko tudi prišlo do vseh bolnikov. Odločilno besedo pri tem imajo plačniki, praviloma javni zdravstveni sistemi, ki morajo presoditi, ali koristi novega zdravila odtehtajo stroške z njim. Odločitve o tem, ali koristi nekega zdravljenja odtehtajo ceno tega zdravljenja, so sestavni del zdravstvene ekonomike.
»Veliko novih zdravil, ne le onkoloških, ima nesorazmerno visoko ceno v primerjavi s klinično koristnostjo. So hudo breme ne le za našo zdravstveno blagajno, temveč tudi za zdravstvene blagajne najbogatejših držav,« pravi dr. Jurij Fürst, vodja oddelka za zdravila na Zavodu za zdravstveno zavarovanje.
Vse več je pozivov, naj se uvede drugačen sistem plačevanja za nova onkološka zdravila, pri katerem bi se cena zdravila prilagodila dejanski klinični koristi za bolnika.
O primernosti financiranja novih zdravil odloča 16-članska neodvisna strokovna komisija. »Merila za ugotavljanje učinkovitosti so postavljena, seveda pa je veliko nejasnosti in mejnih vrednosti, ki otežujejo odločanje,« pravi Fürst.
Letos je komisija že zavrnila financiranje dveh novih onkoloških zdravil in dveh novih terapevtskih indikacij za zdravili, ki ju zavod sicer že financira.
Vse več je pozivov, naj se uvede drugačen sistem plačevanja za nova onkološka zdravila, pri katerem bi se cena zdravila prilagodila dejanski klinični koristi za bolnika. A zaradi strahu, da bi to zavrlo razvoj novih zdravil, za katerega farmacevtske družbe namenjajo milijardne zneske, za zdaj ostaja zgolj pri besedah. Prej ali slej pa se bo nekaj moralo spremeniti. Število bolnikov z rakom neprestano narašča. Od današnjih otrok bo glede na projekcije do starosti 75 let za rakom zbolel vsak drugi moški in vsaka tretja ženska. Zdravstveni sistem sedanjega načina plačevanja ne bo zdržal v nedogled.




Pisma bralcev pošljite na naslov pisma@mladina.si. Minimalni pogoj za objavo je podpis z imenom in priimkom ter naslov. Slednji ne bo javno objavljen.
Pisma bralcev
Drago upanje
V odlično raziskani temi g. Zgonik predstavi kočljivo temo dragih onkoloških zdravil s premajhnim učinkom, glede na velika pričakovanja in cene. Treba je povedati, da čudežnih zdravil za raka z izjemo ali dvema še vedno ni (in jih morda nikoli ne bo), kljub stalnemu napredku in velikem vlaganju v raziskave. A obstajajo še zelo velike rezerve pri raku, predvsem v preventivi. Več